Phó cục trưởng Cục Quản lý Dược Bộ Y tế Tạ Mạnh Hùng vừa ký liên tiếp 3 văn bản xử phạt vi phạm hành chính với 3 tổ chức liên quan đến lĩnh vực dược. Tổng số tiền phạt là 330 triệu đồng,ộctiêuhủylôthuốctrịloãngxươngkémchấtlượkèo bóng đá cúp c1 đồng thời buộc tiêu hủy một lô thuốc chuyên điều trị loãng xương ở người lớn tuổi, phụ nữ mãn kinh để giảm nguy cơ gãy xương.
Cụ thể:
Cục Quản lý dược xử phạt vi phạm hành chính đối với Công ty Unicure Remedies Pvt. Ltd.(India), có địa chỉ trụ sở chính ở India. Đơn vị này sản xuất thuốc Novotec-70, số giấy đăng ký lưu hành: VN-22482-19, số lô sản xuất: E11532001, ngày sản xuất: 5/3/2020, hạn dùng: 4/3/2023. Lô thuốc này vi phạm chất lượng mức độ 2.
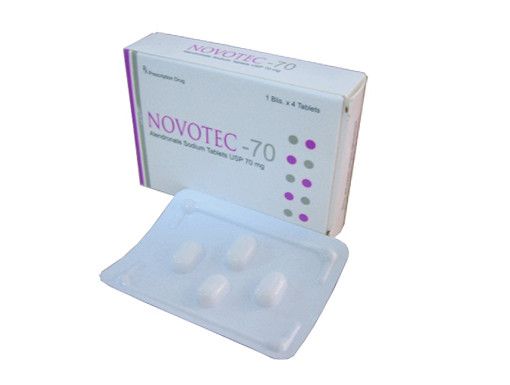
Công ty này bị phạt 70 triệu đồng và buộc tiêu hủy toàn bộ số thuốc vi phạm chất lượng nêu trên. Cơ sở nhập khẩu lô thuốc nêu trên vào Việt Nam là Công ty Cổ phần dược liệu Trung ương 2 (Phytopharma) phải tiến hành thu hồi số thuốc vi phạm chất lượng, thực hiện biện pháp khắc phục hậu quả.
Xử phạt vi phạm hành chính Công ty cổ phần Dược phẩm Phương Đông, có địa chỉ trụ sở chính ở lô số 07, đường số 2, khu công nghiệp Tân Tạo, phường Tân Tạo A, quận Bình Tân, TP.HCM.
Công ty này không thực hiện thủ tục đăng ký thay đổi, bổ sung giấy đăng ký lưu hành với cơ quan nhà nước có thẩm quyền và được phê duyệt trước khi lưu hành thuốc, đối với 8 thuốc: Smodir-DT; Debomin plus; Batigan; Omcetti; Mumcal; Tyrozet; Devitoc và Fudcime.
Ông Hùng cho biết công ty này có nhiều tình tiết tăng nặng khi có hành vi vi phạm nhiều lần đối với nhiều thuốc. Hơn nữa, công ty này cũng không có văn bản đề nghị bổ sung, thay đổi thông tin của thuốc đã kê khai, kê khai lại giá thuốc trong trường hợp có thay đổi so với thông tin đã công bố nhưng giá thuốc không thay đổi đối với 3 thuốc: Bakidol 650 (tên mới: Eagib); Pegianin (tên mới: Roteki) và Ormyco 120mg (tên mới: Ormyco 120).
Tổng số tiền xử phạt với 3 nhóm hành vi vi phạm của Công ty cổ phần Dược phẩm Phương Đông là 160 triệu đồng.
Xử phạt 100 triệu đồng với hành vi vi phạm hành chính của Công ty Cổ phần US Pharma USA, có địa chỉ trụ sở chính: Lô B1-10, đường D2, khu công nghiệp Tây Bắc Củ Chi, ấp Bàu Tre 2, xã Tân An Hội, huyện Củ Chi, TP.HCM.
Công ty này không thực hiện thủ tục đăng ký thay đổi, bổ sung giấy đăng ký lưu hành với cơ quan nhà nước có thẩm quyền và được phê duyệt trước khi lưu hành thuốc đối với các thay đổi lớn, thay đổi nhỏ cần được phê duyệt đối với 8 thuốc: Tabracef; Lotrial S; Glimepirid 2-US; Cardipredson 4; Bitrepso; Robpredni sweet; Robmedtril số lô 030522 và Cefdinir 300.
 Việt Nam thu hồi trên toàn quốc 3 sản phẩm tẩy trang sản xuất ở PhápHai công ty chịu trách nhiệm đưa 3 loại mỹ phẩm ra thị trường không trung thực về tài liệu giấy ủy quyền trong hồ sơ công bố sản phẩm.
Việt Nam thu hồi trên toàn quốc 3 sản phẩm tẩy trang sản xuất ở PhápHai công ty chịu trách nhiệm đưa 3 loại mỹ phẩm ra thị trường không trung thực về tài liệu giấy ủy quyền trong hồ sơ công bố sản phẩm. (责任编辑:Thể thao)
 Gái bán hoa tiết lộ sốc về quý ông 'thực thụ' trong phòng ngủ
Gái bán hoa tiết lộ sốc về quý ông 'thực thụ' trong phòng ngủ Nhóm tin tặc lên tiếng sau vụ hack rúng động ngành năng lượng Mỹ
Nhóm tin tặc lên tiếng sau vụ hack rúng động ngành năng lượng MỹKết quả Wolves vs Arsenal: Pháo thủ giúp MU 'cắt đuôi' Wolves
 Đội hình ra sânWolves: Patricio, Coady, Boly, Saiss, Doherty (Neto 70'), Dendoncker (Jota 55'), Neve
...[详细]
Đội hình ra sânWolves: Patricio, Coady, Boly, Saiss, Doherty (Neto 70'), Dendoncker (Jota 55'), Neve
...[详细]Cà Mau số hoá quản lý khai thác
'Tôi nhận tin nhắn lừa đảo từ Vietinbanh'
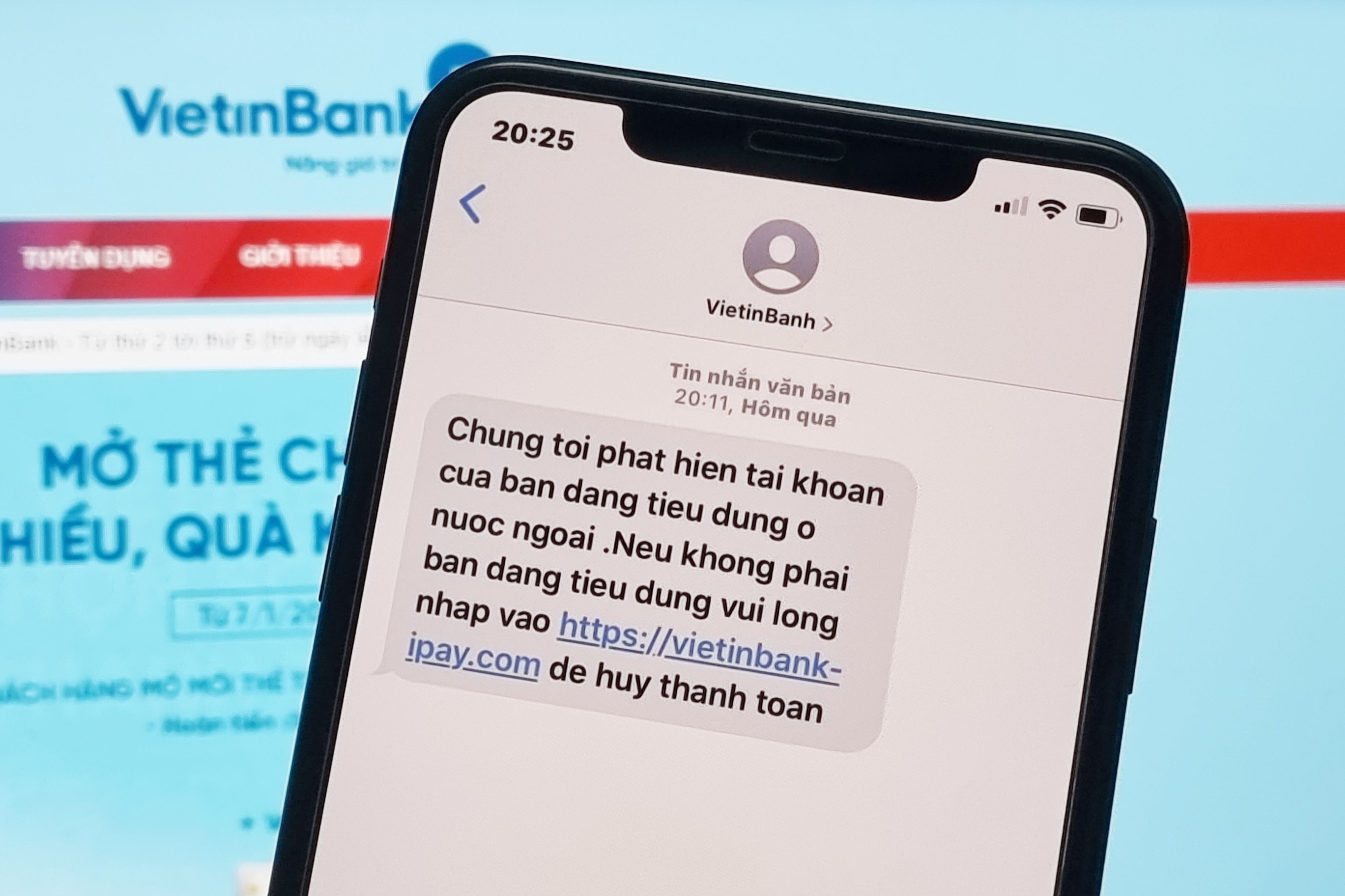 Tối 15/4, nhiều người dùng phản ánh rằng họ nhận được tin nhắn lừa đảo từ brandname "Vietinbanh"."Ch
...[详细]
Tối 15/4, nhiều người dùng phản ánh rằng họ nhận được tin nhắn lừa đảo từ brandname "Vietinbanh"."Ch
...[详细]Hiểm họa từ bếp ga du lịch rình rập sinh viên
 - Ngay sau vụ sập nhà do nổ bình ga ở Hà Nội làm 2 người chết, các sinh viên mới tá hỏa về độ an toà
...[详细]
- Ngay sau vụ sập nhà do nổ bình ga ở Hà Nội làm 2 người chết, các sinh viên mới tá hỏa về độ an toà
...[详细]H'Hen Niê khác lạ sau ồn ào hỏi thí sinh thi hoa hậu thiếu tinh tế
 Trên trang cá nhân, Hoa hậu H'Hen Niê gây chú ý với bộ
...[详细]
Trên trang cá nhân, Hoa hậu H'Hen Niê gây chú ý với bộ
...[详细]Facebook 'dọa' người dùng để được thu thập dữ liệu
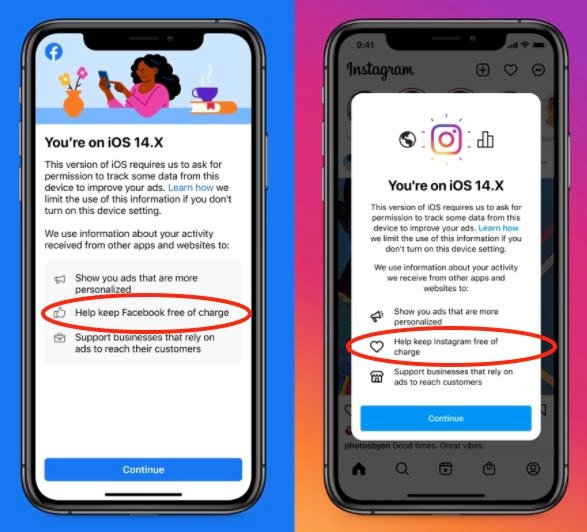 Trong bản cập nhật mới nhất trên iOS 14, ứng dụng Facebook và Instagram hiện lên một thông báo với n
...[详细]
Trong bản cập nhật mới nhất trên iOS 14, ứng dụng Facebook và Instagram hiện lên một thông báo với n
...[详细]Công cụ kiểm tra online máy chủ dùng Microsoft Exchange có tồn tại lỗ hổng mới
Trường tiểu học tổ chức lớp học xanh lớp học mở cho học sinh,
Lý do ông bố ở Thanh Hóa chấp nhận cho con trai duy nhất đi tù
Các nạn nhân vụ lộ thông tin 10.000 người Việt cần làm gì?